이번 주제는 라디칼반응입니다
라디칼반응-서론
라디칼반응은 다음과 같은 특징을 가지고 있습니다
- 라디칼은 하나의 쌍이 없는 전자(single unpaired electron)를 가진 반응성 중간체(reactive intermediate)로, 공유 결합의 균일화(homolysis)에 의해 형성된다.
- 라디칼은 전자의 한 옥텟이 없는 원자를 포함한다.
- 라디칼 반응에는 전자의 이동을 반쪽머리 굽은 화살표로 사용한다.
이때 반쪽머리 굽은 화살표로 표시한다는 점이 중요합니다. 시험에서 급한마음에 평소처럼 일반 화살표를 써서 감점당하는 학생이 많습니다.

라디칼의 구조
탄소 라디칼은 홀전자가 있는 탄소와 결합한 R기의 수에 따라 일차 (1°), 이차(2°) 또는 삼차(3°) 라디칼로 분류됩니다.

탄소 라디칼은 sp2 혼성화 탄소 양이온처럼 sp2 혼성이며 삼각 평면 (trigonal planar)입니다.
혼성화에 참여하지 않은 p 오비탈에는 홀전자가 있으며, 이는 삼각 평면 탄소의 위와 아래쪽에 존재합니다.

결합 해리 에너지
C-H 결합의 분해를 위한 결합 해리 에너지(Bond dissociation energies)는 라디칼 안정성의 척도로 쓰이며, 결합 해리 에너지는 결합을 두 개의 라디칼로 분해하는 데 필요한 에너지를 계산하여 결정합니다.
더 강한 결합을 없애려면 더 많은 에너지가 필요합니다. 아래 예시에서 2° 라디칼은 1° 라디칼보다 안정적인데, 이는 생산에 필요한 에너지가 적기 때문입니다.

라디칼의 안정도
라디칼의 안정도는 알킬기의 수를 생각해야 합니다. 탄소 라디칼과 결합한 알킬기의 수가 많을수록 라디칼의 안정성이 증가합니다.

라디칼 반응의 일반적 특성
라티칼 반응의 일반적인 특성은 다음과 같습니다.
- 라디칼은 열(△)이나 빛(hv)의 형태로 에너지를 가하여 공유 결합으로 부터 생성된다.
- 어떤 반응은 라디칼 개시제(radical initiator)에 의하여 실행되는 반응도 있다.
- 라디칼 개시제는 라디칼 공급원으로서의 역할을 하는 매우 결합이 약한 화합물이다. 가장 보편적으로 사용되는 라디칼 개시제는 일반적으로 RO-OR 구조의 과산화물(peroxide)이다.
- 과산화물을 가열하면 약한 O-O 결합의 균일 분해가 쉽게 일어나서 두 개의 RO· 라디칼이 생성된다.
- 라디칼은 두 가지의 주된 반응을 한다. σ결합과 반응하거나 π결합에 첨가된다.
산소분자에 의한 라디칼 억제제
두 라디칼이 시그마 결합을 형성하기 위해 반응합니다
바닥상태의 전자 배치에서 쌍라디칼(diradical)인 산소와 라디칼 반응은 아래 그림과 같습니다.

산소와의 반응으로 인해 X-O-O. 라디칼은 할로젠 라디칼만큼 반응성이 없기 때문에 반응이 느려지거나 정지됩니다.
라디칼 반응을 억제하는 화합물을 라디칼 억제제(radical inhibitor) 또는 라디칼 포착제(radical scavenger)라고 합니다.
알케인의 할로젠화
빛이나 열이 있을 때 알케인이 할로젠과 반응하면 할로젠화 알킬이 얻어집니다.
알케인의 할로젠화는 F2와는 너무 격렬하고, I2와 반응할 때는 너무 느려서 Cl2와 Br2를 사용할 때만 유용합니다.

탄소에 있는 수소 원자가 할로젠 원자로 대체되었을 때, 일할로젠화 (monohalogenation) 반응이 진행됩니다.
수소 원자가 둘 이상 있는 알케인이라면, 알킬 화합물의 혼합이 발생할 수 있습니다.

과량의 할로젠이 사용되면 수소원자를 할로젠원자로 치환할 수 있습니다.

할로젠화 반응의 메커니즘
할로젠화 반응은 3가지 특징이 있습니다.
- 반응에는 빛, 열 또는 과산화물의 첨가가 필요하다.
이는 빛이나 열은 라디칼 형성을 위한 결합 균일 분해 에너지를 공급한다. 과산화물의 약한 O-O 결합 을 분해하여 라디칼 반응을 개시할 수도 있다는 것을 의미합니다.
- O2는 반응을 억제한다.
이는 쌍라디칼인 O2는 반응 혼합물로부터 라디칼을 제거하여 반응을 중지한다는것을 의미합니다.
- 자리옮김은 관찰되지 않는다.
라디칼은 자리옮김을 하지 않습니다.
라디컬 할로젠화의 단계
개시, 전개, 종결 뚜렷한 세 단계로 진행이 됩니다. 이때 라디칼 할로젠화에서 가장 중요한 단계는 생성물로 이끄는 전파 단계입니다.
- 개시(initation): 두 개의 라디칼이 결합의 균일 분해로 형성되고, 반응을 개시한다.

- 전파(propagation): 한 개의 라디칼은 반응물과 반응하여 새로운 결합과 또 다른 라디칼을 형성한다.

- 종결(terminating): 두 개의 라디칼이 안정한 결합을 형성하기 위하여 결합한다. 새로운 라디칼의 발생이 없는 라디칼의 제거는 반응을 종결시킨다.

할로젠화가 두 단계로 구성되어 두 개의 에너지 장벽이 존재하며, 첫 단계의 전이 상태 에너지가 높기에 첫 번째 단계가 속도 결정 단계가 됩니다.

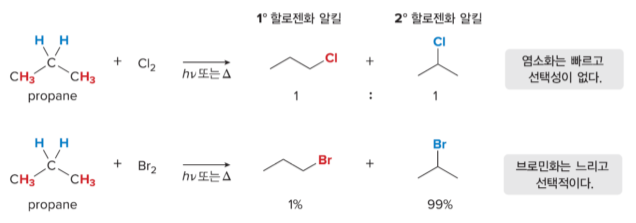
다른 알케인의 염소화
CH3CH2CH3의 염소화는 CH3CH2CH2CI (1°수소의 제거로부터 생성)과 (CH3)2CHCI (2°수소의 제거로부터 생성)의 1:1 혼합물을 생성합니다.
CH3CH2CH3에는 6개의 1°수소와 2개의 2° 수소 원자가 있습니다. 모든 수소의 반응성이 같다면 생성물인 CH3CH2CH2Cl과 (CH3)2CHCI의 비율은 3:1이 됩니다.

염소화와 브로민화의 차이
알케인이 Cl2 및 Br2와 라디칼 치환 반응을 수행하지만, 염소화 및 브로민화는 두 가지 차이점을 보여줍니다.
- 염소화가 브로민화보다 빠르다.
- 염소화는 선택성이 없어서 혼합 생성물을 형성하지만, 브로민화는 일반적으로 선택성이 높기 때문에 한 개의 주생성물을 형성한다.
할로젠화의 에너지
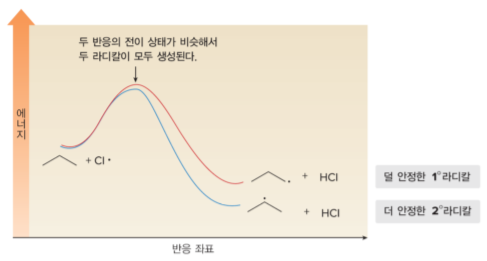
할로젠화에서 속도 결정 단계는 할로젠 라디칼에 의해 수소 원자가 제거되는 과정이기 때문에, 염소화와 브로민화에서 이 단계들을 비교해야 합니다.
1° 또는 2° 수소를 떼어낼 수 있기 때문에 결합 해리 에너지를 이용하여 ΔHf° 를 계산하면, 두 개의 반응이 모두 흡열 과정이라는 것을 알 수 있습니다. 더 안정한 2° 라디칼 형성에 더 적은 에너지가 소모되며, 이 차이는 흡열 과정에서 중요합니다.

브로민화의 흡열 반응에 대한 에너지 도표
흡열 반응의 전이 상태는 생성물과 유사합니다(Hammond postulate). 이때 더 안정한 라디칼이 더 빨리 형성되고, 단일 라디칼 할로젠화 생성물이 주로 생성됩니다.

시험에 도표를 주고 에너지 준위가 왜 차이 나는지를 설명하라는 내용이 나올 수 있으니 확실히 이해해야 합니다.
라디칼 형성의 에너지
염소 라디칼은 1° 또는 2° 수소를 떼어내어 1° 또는 2° 라디칼을 만들 수 있습니다. 결합 해리 에너지를 이용하여 ΔH를 계산하면 두 반응이 모두 발열 과정임을 알 수 있습니다.

염소화의 발열반응의 에너지 도표
염소화는 속도 결정 단계가 발열이기에 양쪽 라디칼을 형성하기 위한 전이 상태가 출발 물질인 CH3CH2CH3를 닮습니다.
결과적으로 두 라디칼의 상대적 안정성이 훨씬 덜 중요하기 때문에 두 라디칼이 모두 형성합니다.
내용과 그림은 스미스의 유기화학 6판을 참조하였습니다. 감사합니다.